
科目: 来源: 题型:选择题
| A. | ②④①⑤⑥ | B. | ②④①⑥⑤ | C. | ①③④②⑤ | D. | ①③④②⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 一定条件下,既可以与Br2发生加成反应,又可以与Br2发生取代反应 | |
| B. | 1 mol该化合物最多可以与3 molNaOH反应 | |
| C. | 既可以催化加氢,又可以在稀硫酸存在下水解得2种有机物 | |
| D. | 可以与Na2CO3溶液反应放出CO2气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④⑥⑦ | C. | ②③④⑤ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:填空题
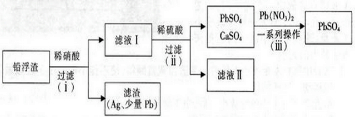
查看答案和解析>>
科目: 来源: 题型:解答题
 镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:
镁、铝、锌是生活中常见的三种金属,查阅资料获得如下信息:| 编号 | 粉末质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 2.0 g | 10.0 mL | 346.2 mL |
| ② | 2.0 g | 10.0 mL | 335.0 mL |
| ③ | 2.0 g | 10.0 mL | 345.8 mL |

查看答案和解析>>
科目: 来源: 题型:解答题
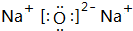 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{a}{b}$ | B. | $\frac{a}{2b}$ | C. | $\frac{a}{a+2b}$ | D. | $\frac{b}{a}$ |
查看答案和解析>>
科目: 来源: 题型:解答题
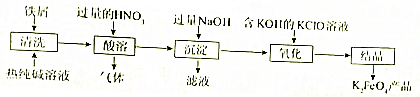
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com