
科目: 来源: 题型:选择题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子数的数目为0.1NA | |
| B. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| C. | 1mol Na2O2固体中含离子总数为4 NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 稀盐酸可除去烧瓶内残留的MnO2 | B. | 可用无色广口玻璃瓶保存氨水 | ||
| C. | 稀硝酸可除去试管内壁粘有的硫磺 | D. | 煮沸自来水可除去其中的Ca(HCO3)2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O、Na2O2、FeO、Fe2O3都是碱性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 纯碱、烧碱、四氯化碳均为电解质 | |
| D. | 水玻璃、氯水、漂白粉均为混合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 式量为30的碳、氢、氧组成的化合物无同分异构体 | |
| B. | 式量为128的烃的分子式不一定是C9H20 | |
| C. | 烃的式量可以是偶数,也可以是奇数 | |
| D. | 有机物分子中,H原子数可以是偶数,也可以是奇数 |
查看答案和解析>>
科目: 来源: 题型:解答题
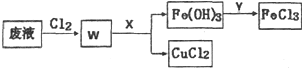 铜及其化合物在工农业生产中有着广泛的用途.
铜及其化合物在工农业生产中有着广泛的用途.查看答案和解析>>
科目: 来源: 题型:解答题
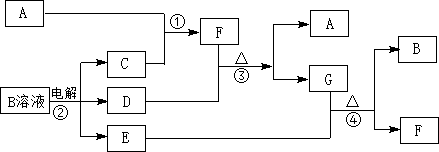 (1)写出化学式FNH3,
(1)写出化学式FNH3,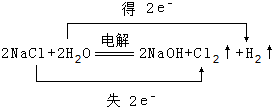 .
.查看答案和解析>>
科目: 来源: 题型:解答题
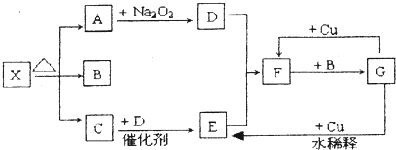
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Zn2+、Fe2+和Cu2+ | B. | Zn2+、Fe3+和Cu2+ | C. | Fe2+和Zn2+ | D. | Cu2+ 和Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com