
科目: 来源: 题型:解答题
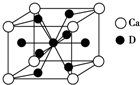 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:3Ba2++3SO42-+2Al3++6OH-═2BaSO4↓+2Al(OH)3↓ | |
| B. | 醋酸除去水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 碳酸氢钠和偏铝酸钠反应:HCO3-+AlO2-+H2O═CO32-+Al(OH)3↓ | |
| D. | 向硫酸铜中加入过量氨水:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 0.1mol 对苯二甲酸中含有双键的数目为0.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
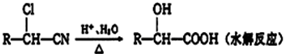
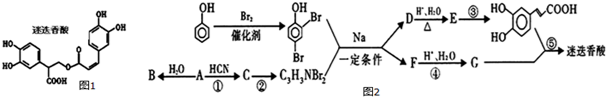
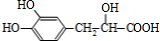 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$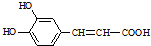 +H2O
+H2O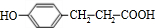 .
.查看答案和解析>>
科目: 来源: 题型:解答题
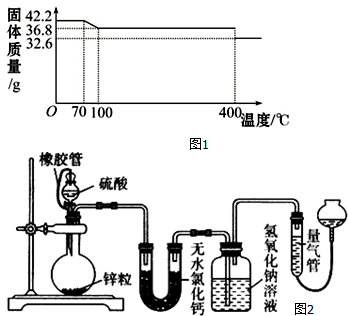
| 实验 溶液 | A | B | C | D | E |
| 5mol/LH2SO4 mL | 40 | V1 | V2 | V3 | V4 |
| 饱和CuSO4液 mL | 0 | 1 | 2 | V5 | 10 |
| H2O mL | V6 | V7 | V8 | 5 | 0 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:选择题
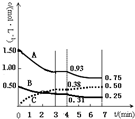 有A、B、C三种气体在一个固定容积的容器中发生反应,体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )
有A、B、C三种气体在一个固定容积的容器中发生反应,体系中各物质浓度随时间变化的曲线如图所示.下列说法不正确的是( )| A. | 该反应的化学方程式为3A(g)+B(g)═2C(g) | |
| B. | 若将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 | |
| C. | 若第4 min 时降低温度,到7 min时达到了新的平衡,则此反应的△H<0 | |
| D. | 反应在前3 min的平均反应速率υ(A)=0.31mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该元素的单质性质活泼,具有较强的还原性,可以用于某些金属冶炼 | |
| B. | 该元素的单质常温下不与浓硫酸反应 | |
| C. | 该元素的单质无需特别保存,因为其性质稳定,不易与空气成分反应 | |
| D. | 该元素的最高价氧化物对应的水化物只能与酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com