
科目: 来源: 题型:选择题
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| C. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
查看答案和解析>>
科目: 来源: 题型:解答题


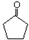 ,G中官能团的名称为碳碳双键、酯基.
,G中官能团的名称为碳碳双键、酯基. ,反应类型加成反应.
,反应类型加成反应.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | BaCl2 NaOH NaHCO3 | B. | AlCl3 NH3•H2O NaOH | ||
| C. | Ba(OH)2 CaCl2 Na2SO4 | D. | Na2CO3 MgCl2 H2SO4 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
. .
.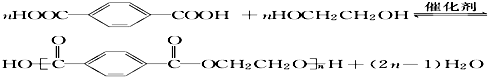 .
.查看答案和解析>>
科目: 来源: 题型:解答题
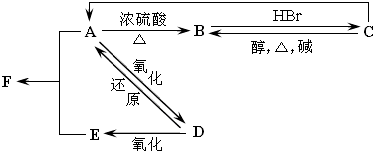
查看答案和解析>>
科目: 来源: 题型:解答题
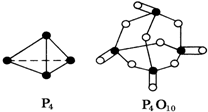 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.| 化学键 | P-P | P-O | O═O | P═O |
| 键能KJ/mol | 197 | 360 | 499 | a |
查看答案和解析>>
科目: 来源: 题型:解答题



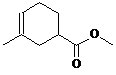 、
、 .
. 任意一种.
任意一种.查看答案和解析>>
科目: 来源: 题型:解答题
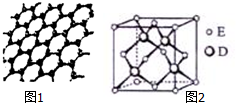 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族且相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族且相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
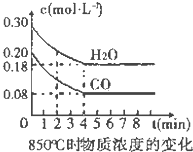 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:Na>Si>Cl | B. | 还原性:Na>Mg>Al | ||
| C. | 稳定性:SiH4>H2S>HCl | D. | 酸性:H3PO4<H2SO4<HClO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com