
科目: 来源: 题型:选择题
| A. | 甲苯与氢气完全加成后的产物的一氯代物有5种 | |
| B. | 分子式为C4H9Br的卤代烃 (不考虑立体异构)有4种 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸[CH3CH(NH2)COOH]脱水缩合最多可形成4种二肽 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.7克-OH中含有的电子数为NA | |
| B. | 42g乙烯与丙烯的混合气体中含碳原子数为3NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA | |
| D. | 乙烯和乙醇的混合物共0.1mol,完全燃烧所消耗的氧气的分子数一定为0.6 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是有机高分子材料 |
查看答案和解析>>
科目: 来源: 题型:解答题
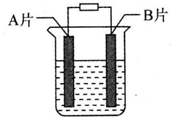 【实验目的】利用所学知识,设计原电池装置.
【实验目的】利用所学知识,设计原电池装置.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向某溶液中加稀盐酸,将产生的无色气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有CO32-或HCO3- | |
| B. | 向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定有SO42- | |
| C. | 向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则原溶液中存在NH4+ | |
| D. | 分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液不能一次性鉴别出来 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 16 g O2中含有的氧分子数为NA | |
| B. | 1 mol Mg变为Mg2+时失去的电子数目为2NA | |
| C. | 常温常压下,11.2 L H2中含有的氢分子数为0.5NA | |
| D. | 1 mol•L-1 CaCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com