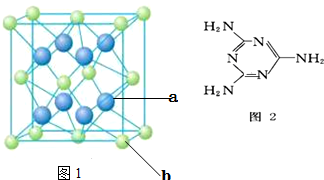
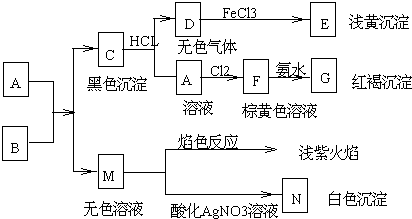
4.一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co
2O
3•CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.
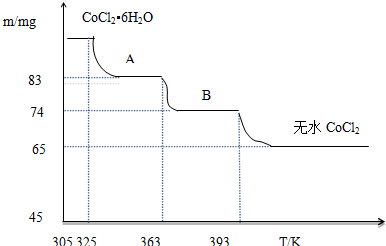
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的化学反应方程式为2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑.
(2)过程II中加入稀H
2SO
4酸化后,再加入Na
2S
2O
3溶液浸出钴.则浸出钴的离子反应方程式为(产物中只有一种酸根)4Co
2O
3•CoO+S
2O
32-+22H
+=12Co
2++2SO
42-+11H
2O.请从反应原理分析不用盐酸酸化的主要原因Co
2O
3•CoO可氧化盐酸产生Cl
2,污染环境.
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用:2Al
3++3CO
32-+3H
2O=2Al(OH)
3↓+3CO
2↑;Co
2++CO
32-=CoCO
3↓.
(4)某天然碱的化学式可表示为2Na
2CO
3•NaHCO
3•2H
2O,取少量该物质溶于水得稀溶液P.下列有关溶液P中微粒的物质的量浓度关系正确的是AD(填序号).
A.c(CO
32-)>c(HCO
3-)>c(OH
-)>c(H
+)
B.c(OH
-)=c(H
+)+c(HCO
3-)+2c(H
2CO
3)
C.3c(Na
+)>5c(CO
32-)+5c(HCO
3-)+5c(H
2CO
3)
D.将P溶液与少量NaOH溶液混合:c(Na
+)+c(H
+)=c(HCO
3-)+2c(CO
32-)+c(OH
-)
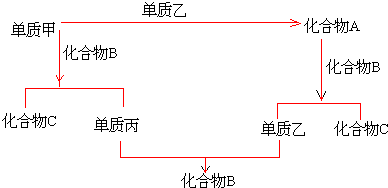
(5)CoO溶于盐酸可得粉红色的CoCl
2溶液.CoCl
2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl
2吸水变色这一性质可制成变色水泥和显隐墨水.如图是粉红色的CoCl
2•6H
2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是CoCl
2•H
2O.

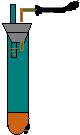 如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:
如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处: ,P元素属于ds区元素.
,P元素属于ds区元素.