
科目: 来源: 题型:解答题
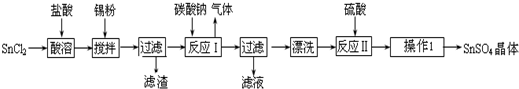
查看答案和解析>>
科目: 来源: 题型:解答题
| A | B | |
| C | D |
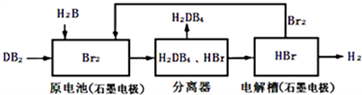
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
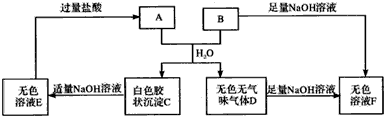
查看答案和解析>>
科目: 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将0.2 mol•L-1Na2CO3和0.1 mol•L-1NaHCO3溶液等体积混合,则溶液中:3c(OHˉ)=3c(H+)+2c(HCO3ˉ)+5c(H2CO3)+c(CO32ˉ) | |
| C. | 根据上表,反应ClOˉ+H2O?HClO+OHˉ的水解常数Kh≈10ˉ7.6 | |
| D. | 向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙中C的转化率为20% | |
| B. | Q1+Q2=Q | |
| C. | 达到平衡后,再向乙中加入0.25 molA、0.75molB、1.5molC,平衡向正反应方向移动 | |
| D. | 乙中的热化学反应方程式为2C(g)?A(g)+3B(g);△H=+Q2kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
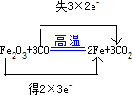 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ②③⑤ | D. | 只有③ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 加入较多NaHSO4的溶液中:Fe3+、Cl-、NO3-、Na+ | |
| B. | 通入大量CO2气体的溶液中:Na+、Ba2+、Cl-、NO3- | |
| C. | 通入大量NH3的溶液中:Ca2+、Na+、HCO3-、Cl- | |
| D. | 通入大量SO2气体的溶液中:Na+、SO32-、NH4+、SO42- |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 溶液中[Na+]增大,有O2放出 | B. | 溶液PH值不变,有H2放出 | ||
| C. | 溶液中Na+数目减少,有O2放出 | D. | 溶液中PH值不变,有O2放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com