
科目: 来源: 题型:解答题
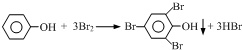
查看答案和解析>>
科目: 来源: 题型:解答题
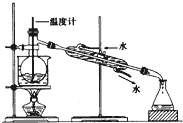
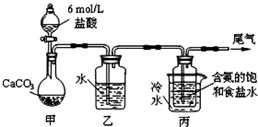 碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.
碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.查看答案和解析>>
科目: 来源: 题型:解答题
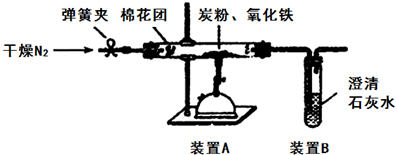
查看答案和解析>>
科目: 来源: 题型:解答题
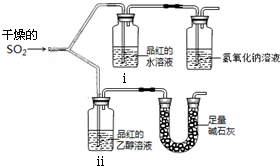 实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:
实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
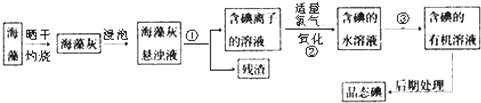
查看答案和解析>>
科目: 来源: 题型:填空题
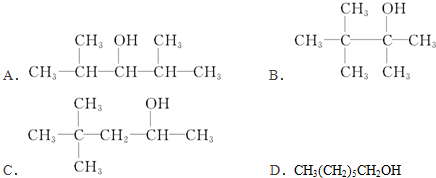
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| D. | 在101 kPa,298 K条件下,1 mol S和2 mol S的燃烧热相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;
; ;C的化学名称为2,3-二甲基-1,3-丁二烯.
;C的化学名称为2,3-二甲基-1,3-丁二烯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com