
科目: 来源: 题型:选择题
| A. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8 kJ•mol-1,则H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 已知:S(g)+O2(g)═SO2(g)△H1=-Q1;S(s)+O2(g)═SO2(g)△H2=-Q2,则Q1<Q2 | |
| C. | 已知:$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1; CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)△H2,则有|△H1|<|△H2| | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJ•mol-1 CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 C(石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
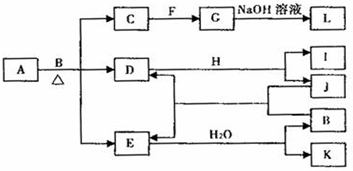
查看答案和解析>>
科目: 来源: 题型:解答题
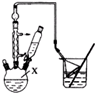 对叔丁基苯酚
对叔丁基苯酚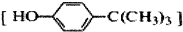 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.查看答案和解析>>
科目: 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
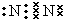 ,在这些元素中,化学性质最不活泼的是:Ar
,在这些元素中,化学性质最不活泼的是:Ar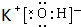 .
.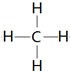 .
. ,该化合物属于离子 (填“共价”或“离子”)化合物.
,该化合物属于离子 (填“共价”或“离子”)化合物.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2SO3溶液中:c(H+)+c(HSO3-)+2c(H2SO3)═c(OH-) | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 有些化学反应既属于复分解反应又属于氧化还原反应 | |
| D. | 常温下,将pH=3的HA和PH=11的BOH等体积混合后pH>7,可能生成了弱酸强碱盐 |
查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
查看答案和解析>>
科目: 来源: 题型:解答题
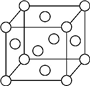
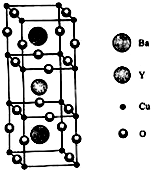 铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.
铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目: 来源: 题型:解答题
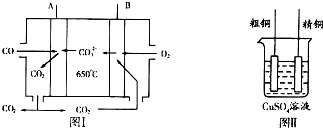
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com