
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
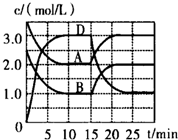 温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )| A. | 反应在前10min的平均反应速率v(B)=0.15mol/(L•min) | |
| B. | 该反应的平衡常数表达式K=$\frac{{c}^{2}(D)}{c(A)•c(B)}$ | |
| C. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| D. | 反应至1.5min时,改变的反应条件是降低温度 |
查看答案和解析>>
科目: 来源: 题型:解答题
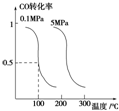 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.查看答案和解析>>
科目: 来源: 题型:解答题
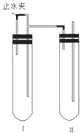
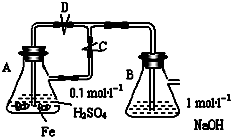
 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2
在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4制备Fe(OH)2查看答案和解析>>
科目: 来源: 题型:解答题
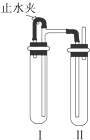 用下面两种方法均可制得Fe(OH)2白色沉淀.
用下面两种方法均可制得Fe(OH)2白色沉淀.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.3mol | B. | 0.4mol | C. | 0.5mol | D. | 0.6mol |
查看答案和解析>>
科目: 来源: 题型:解答题
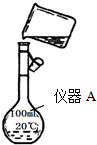
查看答案和解析>>
科目: 来源: 题型:解答题
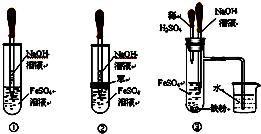
 用下面两种方法可以制得白色的Fe(OH)2沉淀.
用下面两种方法可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目: 来源: 题型:解答题
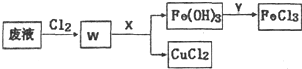
 某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:[废铁屑]$\stackrel{盐酸}{→}$[A溶液]$\stackrel{氯气}{→}$[氯气铁溶液]
某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:[废铁屑]$\stackrel{盐酸}{→}$[A溶液]$\stackrel{氯气}{→}$[氯气铁溶液]查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com