
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗2Na+O2═Na2O2 | |
| B. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀 SO42-+Ba2+═BaSO4↓ | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | 碳酸钙溶于醋酸CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
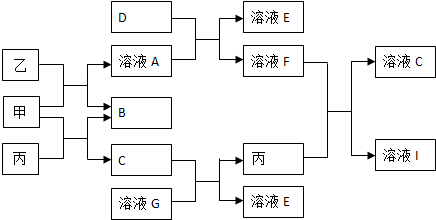
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 充电过程是化学能转化为电能的过程 | |
| B. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放电时负极附近溶液的酸性增强 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
查看答案和解析>>
科目: 来源: 题型:解答题
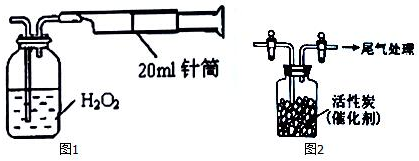
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 2.0 | 3.0 | 3.0 | 2.0 | 5.2 |
| 3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
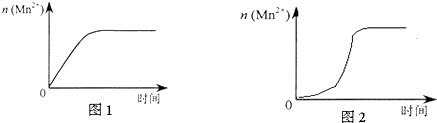
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目: 来源: 题型:解答题


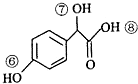 )的说法正确的是AD.
)的说法正确的是AD.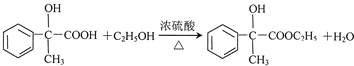 .
.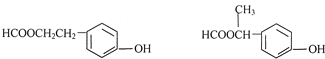 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com