
科目: 来源: 题型:选择题
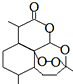 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素可以起取代反应 | B. | 青蒿素中的氧均为-2价 | ||
| C. | 青蒿素可以和NaOH溶液反应 | D. | 青蒿素的分子式为C15H22O5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| X | NaOH溶液 | KOH溶液 | O2 | FeCl3溶液 |
| Y | Al(OH)3 | SiO2 | N2 | Cu |
| Z | 稀硫酸 | 浓盐酸 | H2 | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3中含有的分子数为NA个 | |
| B. | 标准状况下,2.24 L NH3和CH4的混合气体,所含电子总数为2NA | |
| C. | 7.1 g Cl2与足量的铁反应转移的电子数目是0.3NA | |
| D. | 1 mol C5H12分子中共价键总数为16NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 自然界中,不存在镁单质,碳元素多种单质 | |
| B. | CO可以还原氧化铜,Mg能还原CO2,反应类型均为置换反应 | |
| C. | 电解熔融氯化镁可制备Mg单质和氯气,海水提取海盐后的卤水可用于提取氯化镁 | |
| D. | 煤与水蒸气高温反应生成水煤气,其主要成分是CO和H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ②④ | D. | ①③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 氢氧化铝、碳酸氢钠都可用于治疗胃酸过多 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入适量食品添加剂 | |
| D. | 用化纤面料替代棉质面料,以减少二氧化碳的排放 |
查看答案和解析>>
科目: 来源: 题型:选择题
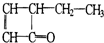 ,可表示为
,可表示为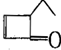 ,某有机物
,某有机物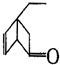 的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 9种 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
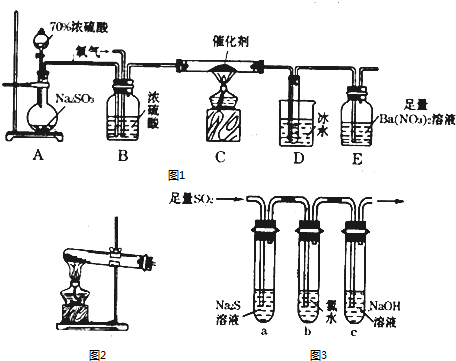
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com