
科目: 来源: 题型:解答题
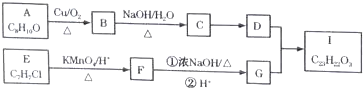
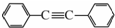 .以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
.以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下: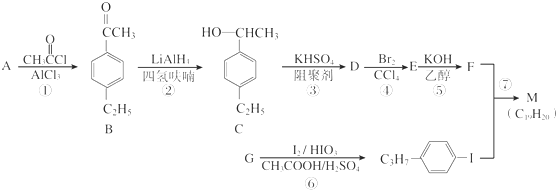
 .
. .
.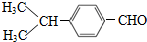 (写结构简式).
(写结构简式).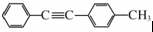 的合成路线:
的合成路线: .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
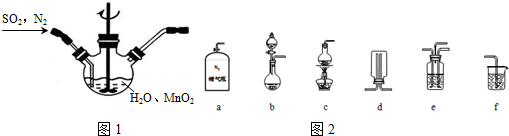
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物的水化物的酸性:Y>Z | |
| C. | 化合物WZ2中各原子均满足8电子的稳定结构 | |
| D. | Y、Z均能与碳元素形成共价化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 78 g Na2O2中存在的共价键总数为NA | |
| B. | 0.1 mol${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 氢氧燃料电池负极消耗2.24 L气体时,电路中转移的电子数为0.1NA | |
| D. | 0.1 mol氯化铁溶于1L水中,所得溶液中Fe3+的数目为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| B. | 甲醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| C. | ABS树脂、光导纤维及碳纤维都是有机高分子材料 | |
| D. | 酸性条件下,C2H5CO18OC2H5的水解产物是C2H5CO18OH和C2H5OH |
查看答案和解析>>
科目: 来源: 题型:解答题
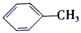 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$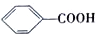
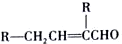
 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
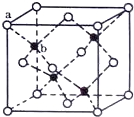 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性查看答案和解析>>
科目: 来源: 题型:解答题
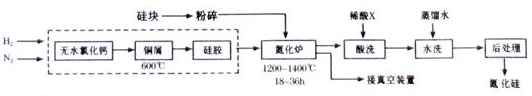
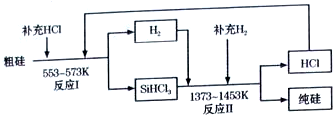
查看答案和解析>>
科目: 来源: 题型:选择题
| 步驟序号 | 操作步骤 | 现 象 |
| (1) | 用pH试纸检验 | 溶液的pH>7 |
| (2) | 向溶液中滴加氯水,再加人CC14、振荡、静置 | 下层呈橙色 |
| (3) | 向(2)所得水溶液中加人Ba(N03)2溶液和 稀 HNO3 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加人AgNO3溶液和稀HNO, | 有白色沉淀产生 |
| A. | 不能确定的离子是① | B. | 不能确定的离子是②③ | ||
| C. | 肯定含有的离子是①④⑥ | D. | 肯定没有的离子是②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com