
科目: 来源: 题型:选择题
 阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种历史悠久的解热镇痛药.下列有关说法正确的是( )
阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种历史悠久的解热镇痛药.下列有关说法正确的是( )| A. | 与乙酰水杨酸具有相同官能团的芳香族同分异构体共有8种(不考虑立体异构) | |
| B. | 乙酰水杨酸的所有原子均在同一平面上 | |
| C. | 乙酰水杨酸能发生取代、加成、氧化、还原反应 | |
| D. | 乙酰水杨酸易溶于水、乙醇等溶剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 与漂白粉溶液反应的离子方程式:Ca2++SO32-═CaSO3↓ | |
| B. | 通入SO2至过量:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| C. | 通入HCl至溶液pH=7:c(HSO3-)<c(Cl-) | |
| D. | 加入NaOH固体可使溶液中水的电离程度增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | m=y,H2O 是还原产物 | B. | n=2m,R2+ 是还原剂 | ||
| C. | m=4,O2发生氧化反应 | D. | m=2y,R2+ 被氧化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 事实或实验 | 结论 |
| A | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| B | 向某溶液中滴加氯水,再加入KSCN溶液,溶液呈红色 | 原溶液中一定含有Fe2+ |
| C | 汽车尾气净化反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△S<0 | 该反应在常温不能自发进行 |
| D | 向NaBr溶液中滴入少量氯水和CCl4,振荡,静置溶液下层呈红色 | Br-还原性强于Cl- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.3g钠由原子变成离子时,失去的电子数目为0.2NA | |
| B. | 0.2NA个硫酸分子与19.6g磷酸分子含有相同的氧原子数 | |
| C. | 28g氮气所含原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为2:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水中加入盐酸Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片加入稀硝酸中3Cu+2NO3-+8H+═3Cu2++2N0↑+4H20 | |
| D. | 小苏打溶液和盐酸混合CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:多选题
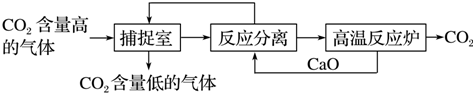
| A. | 生产过程中,可循环利用的物质有CaO和NaOH | |
| B. | 该方法涉及了化合、分解和复分解等反应类型 | |
| C. | 该方法通过化学变化,分离、提纯并利用CO2,可以减少碳的排放 | |
| D. | “反应分离”环节中,分离物质的基本操作是蒸发、结晶 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol苯乙烯(C6H5CH=CH2)中含有的碳碳双键数目为4NA | |
| B. | 加热条件下,MnO2与浓盐酸反应生成7.1gCl2,转移的电子数目为0.2NA | |
| C. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| D. | 常温下,1L0.1mol•L-1的CH3COOH溶液中含有的H+数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com