
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用碳酸氢钠焙制糕点 | B. | 在易碎的食品包装袋中充入氮气 | ||
| C. | 炖排骨时滴加一定量的食醋 | D. | 用霉变花生(含黄曲霉素)压榨花生油 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
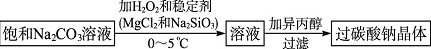
查看答案和解析>>
科目: 来源: 题型:解答题
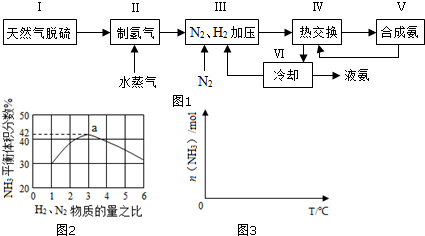
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(H+)>c(OH-)>c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$) | B. | c(H+)>c(HCO${\;}_{3}^{-}$)>c(CO${\;}_{3}^{2-}$)>c(H2CO3) | ||
| C. | c(H2CO3)=2c(H+)+c(CO${\;}_{3}^{2-}$) | D. | c(H+)=c(OH-)+c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$) |
查看答案和解析>>
科目: 来源: 题型:解答题
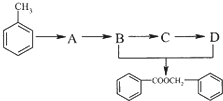
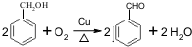 .
. 的化学方程式为
的化学方程式为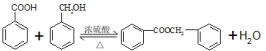 .
.查看答案和解析>>
科目: 来源: 题型:解答题
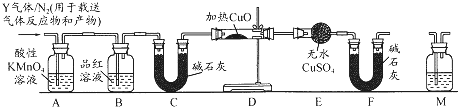
查看答案和解析>>
科目: 来源: 题型:解答题
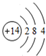 .
. ;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com