
科目: 来源: 题型:解答题
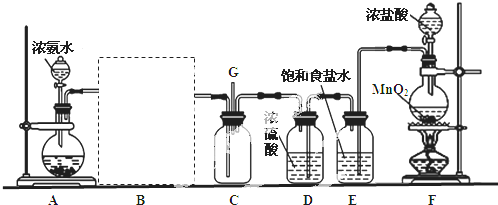
查看答案和解析>>
科目: 来源: 题型:选择题
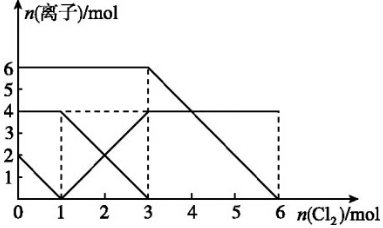
| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为3 mol | |
| C. | 当通入1mol Cl2时,溶液中已发生的反应为2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氟化氢气体分解生成氢气和氟气的反应是放热反应 | |
| B. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270kJ | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 放热反应的反应速率总是大于吸热反应的反应速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2S2O3溶液显弱酸性的原因是:H2S2O3?H++HS2O3- | |
| B. | Na2S2O3溶液显碱性的原因是:S2O32-+2 H2O?H2S2O3+2OH- | |
| C. | Na2S2O3和AgBr反应的离子方程式是:2S2O32-+AgBr?Ag(S2O3)23-+Br- | |
| D. | 定影不能在酸性较强的溶液中进行的原因是:S2O32-+2H+=S↓+SO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D | |
图示 | 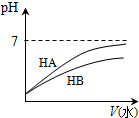 | 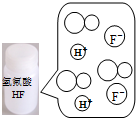 | 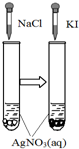 | 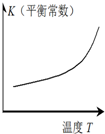 |
| 结论 | HB为弱酸 | HF为弱电解质 | 溶解度:AgI<AgCl | 正反应△H>0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol | B. | 1.33mol | C. | 0.667mol | D. | 0mol |
查看答案和解析>>
科目: 来源: 题型:解答题
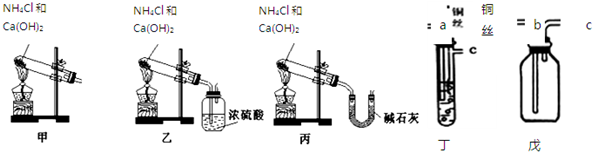
 2NH3.
2NH3.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴定管和锥形瓶在使用前要用润洗 | |
| B. | 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 | |
| D. | 将CO2和SO2混合气体分别通入BaC12溶液、Ba(NO3)2溶液中,最终都有沉淀生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在食用盐中滴加少量淀粉溶液,探究食用盐是否含有IO3- | |
| B. | 新制氯水显酸性,将其滴加到紫色石蕊溶液中,充分振荡后溶液最终为无色 | |
| C. | 氯气具有漂白性,可以将湿润的有色布条漂白为无色物质 | |
| D. | 根据较强酸可以制取较弱酸的规律,结合酸性的强弱顺序H2CO3>HClO>HCO3-,可以推出少量的CO2通入NaClO溶液中能生成HClO和碳酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com