
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3 溶液加入到1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN 溶液 | 溶液变红 |

| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
查看答案和解析>>
科目: 来源: 题型:解答题
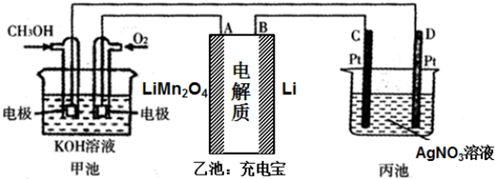
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该混合粉末从组成看,其成分皆是碱性氧化物 | |
| B. | 溶液Y 中2n(Mg2+)<n(Cl-)<3n(Fe3+) | |
| C. | 沉淀X的成分为二氧化硅 | |
| D. | 在溶液Y 中加入过量的氨水,过滤得到的沉淀的成分是氢氧化铁和氢氧化镁 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu2+ Fe2+ | B. | H+ | C. | Cu2+ Fe3+ | D. | Fe2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碘酒是指碘单质的乙醇溶液 | |
| B. | 浓硫酸可以刻蚀石英制艺术品 | |
| C. | 84消毒液的有效成分是NaClO | |
| D. | 氢氧化铝、小苏打等可用于治疗胃酸过多 |
查看答案和解析>>
科目: 来源: 题型:解答题
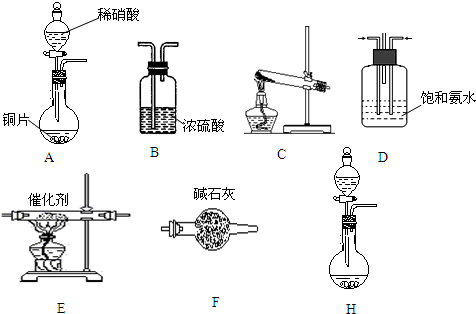
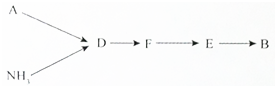
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有①② | B. | 只有①③ | C. | 只有②③ | D. | 只有③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠在实验室通常保存在煤油中,可推知锂也可保存在煤油中 | |
| B. | FeCl2与Cl2反应生成FeCl3,可推知FeBr2也可与Br2反应生成FeBr3 | |
| C. | 工业制Mg采用电解MgCl2的方法,可推知工业制Al也采用电解AlCl3的方法 | |
| D. | CO2通入Ba(NO3)2溶液中无明显现象,可推知SO2通入Ba(NO3)2溶液中也无明显现象 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应中KBrO3得电子作氧化剂 | |
| B. | 氧化剂和还原剂的物质的量比为5:8 | |
| C. | 根据上述反应可推知,还原性:AsH3>Br2 | |
| D. | 0.2 mol KBrO3参加反应电子转移1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com