
科目: 来源: 题型:选择题
| A. | c(Na+)>c(HS-)>c(OH-)>c (H2S) | B. | c (Na+)+c (H+)=c (S2-)+c (OH-)+c (HS-) | ||
| C. | 2c (Na+)=c (S2-)+c (H2S)+c (HS-) | D. | c(Na+)>c(S2-)>c(OH-)>c (H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 热的纯碱溶液去除油污能力更强 | |
| B. | NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火器 | |
| C. | 保存FeSO4溶液时加入少量铁粉 | |
| D. | 把AlCl3溶液加热蒸干灼烧至质量不再变化得到Al2O3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHCO3═CO32-+H++Na+ | B. | S2-+H2O?H2S+2 OH- | ||
| C. | H3PO4?3H++PO43- | D. | NH3•H2O?NH4++OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 自发反应都是放热反应 | B. | 自发反应都是熵增加的反应 | ||
| C. | 自发反应都是△G<0的反应 | D. | 自发反应都是△G>0的反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内生成a mol A,同时生成3a mol B | |
| C. | A、B、C的浓度不再变化 | |
| D. | 混合气体的总压强不再变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
科目: 来源: 题型:解答题
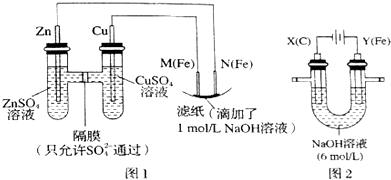
查看答案和解析>>
科目: 来源: 题型:解答题
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目: 来源: 题型:解答题
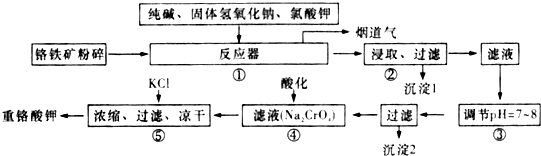
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com