
科目: 来源: 题型:选择题
| A. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| B. | 一定量的Fe与稀HNO3反应生成的盐中一定只有Fe(NO3)3 | |
| C. | 证明溶液中含Fe2+不含Fe3+的方法是先加KSCN溶液,溶液不变红色,然后加入氯水溶液变红色 | |
| D. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入Cu粉,然后过滤 |
查看答案和解析>>
科目: 来源: 题型:解答题

 ;
; +3NaOH $→_{高压}^{高温}$
+3NaOH $→_{高压}^{高温}$ +NaCl+2H2O;
+NaCl+2H2O; ;
; (任写一种结构简式).
(任写一种结构简式).查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 ,NaH与H2O反应的化学方程式为NaH+H2O═NaOH+H2↑.
,NaH与H2O反应的化学方程式为NaH+H2O═NaOH+H2↑.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在加热搅拌条件下加入MgO,可除去MgCl2溶液中的Fe3+ | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,c(Mg2+)一样大(已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11) | |
| D. | 常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
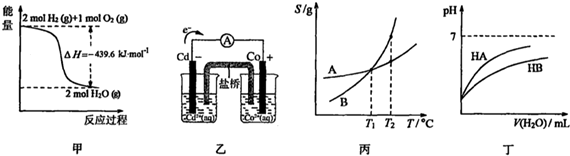
| A. | 由甲可知:氢气的燃烧热为219.8kJ/mol | |
| B. | 由乙可知:盐桥中的Cl-向Cd电极移动 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数:A=B | |
| D. | 由丁可知:同温度、同浓度的NaA溶液与NaB溶液相比,其PH:NaA<NaB |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3?H2O能大量共存 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com