
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
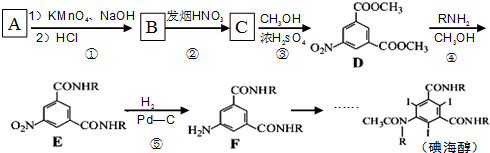
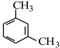 .
.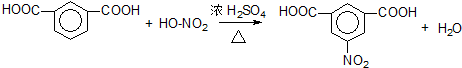 .
. 、
、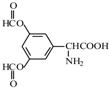 .
.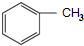 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 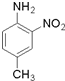 的合成路线流
的合成路线流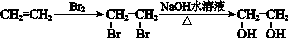
 呈弱碱性,易被氧化
呈弱碱性,易被氧化 的合成路线流程图:
的合成路线流程图: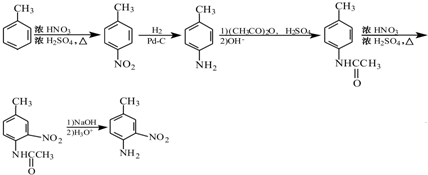 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
 近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:
近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:| 实验序号 | c(NH4+)/mol•L-1 | c(NO2-)/mol•L-1 | ν/mol•L-1•s-1 |
| 1 | 0.0100 | 0.200 | 5.4×10-7 |
| 2 | 0.0200 | 0.200 | 1.08×10-6 |
| 3 | 0.200 | 0.040 | 2.16×10-6 |
| 4 | 0.200 | 0.060 | 3.24×10-6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 若b的最高价氧化物对应水化物为H2bO4,则a的氢化物的化学式为aH3 | |
| B. | 若b的单质可作半导体材料,则c的单质不可能为半导体材料 | |
| C. | 若b的单质与H2易化合,则c的单质与H2更易化合 | |
| D. | a与b之间容易形成离子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解精炼铜时,阳极质量减少6.4g,电路中电子转移的总数为0.2NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | NA个CH4在标准状况下的体积约为22.4L | |
| D. | 苯与液溴反应生成1mol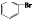 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 青蒿素易溶于水和酒精 | |
| B. | 青蒿素中含多个环状结构,其中有一个六元碳环 | |
| C. | 青蒿素中含过氧键,过氧键属于极性共价键 | |
| D. | 青蒿素和纤维素都属于高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com