
科目: 来源: 题型:填空题
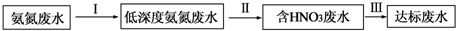

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度,KW增大,pH变小 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸,c(H+)增大,KW变小 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
| 能量/kJ•mol-1 | 0 | -394 | 52 | -242 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下反应 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3?H2O能大量共存 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第一次剩余4.8 g金属为铜和铁 | |
| B. | 稀硝酸的物质的量浓度为1.0 mol•L-1 | |
| C. | 原混合物中铜和铁各0.075 mol | |
| D. | 再加入上述100 mL稀硝酸,又得到标准状况下1.12 L NO |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )
可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )| A. | 若a=1,则A为液体或固体 | |
| B. | 该反应正反应为放热反应 | |
| C. | T2>T1,p2>p1 | |
| D. | 其他条件不变,增加B的物质的量,化学平衡向正反应方向移动,化学平衡常数K增大 |
查看答案和解析>>
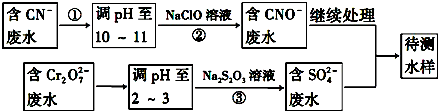
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com