
科目: 来源: 题型:选择题
| A. | Na2FeO4在净水过程中能转变成氢氧化铁 | |
| B. | Na2FeO4能杀菌消毒 | |
| C. | Na2FeO4能除去水中的硫化氢等还原性气体杂质 | |
| D. | Na2FeO4能吸附水中的颜色和固体颗粒 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | x=1 | |
| B. | B的转化率为20% | |
| C. | 平衡时A的浓度为1.50mol/L | |
| D. | 达到平衡时,在相同温度下容器内混合气体的压强与反应前相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③⑥⑤④⑧⑦⑨ | B. | ①②⑤③⑥④⑧⑦⑨ | C. | ①②③④⑤⑧⑥⑦⑨ | D. | ①②③⑤⑥④⑧⑦⑨ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①②⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食盐加碘所添加的是碘酸钾 | |
| B. | 油脂既能为人体提供热量,又能提供人体必需脂肪酸 | |
| C. | 棉花、羊毛及合成纤维完全燃烧都只生成二氧化碳和水 | |
| D. | 蛋白质遇饱和硫酸铵溶液产生的沉淀能重新溶于水 |
查看答案和解析>>
科目: 来源: 题型:解答题
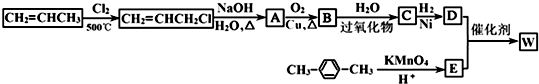
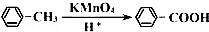
 .
.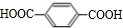 →
→ +2H2O.
+2H2O.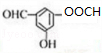 .
.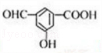 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中和10 mL 0.1 mol•L-1 醋酸与中和100 mL 0.01 mol•L-1的醋酸所需同种碱溶液的量不同 | |
| B. | 常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液中,由水电离产生的c(OH-)相等 | |
| C. | 向NH4Cl溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强 | |
| D. | 向饱和石灰水中加入少量CaO,恢复至室温后溶液中c(OH-)增大,导电能力增强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 22.4L CO | B. | 4.4g CO2 | C. | 8 g SO3 | D. | 24.5g H2SO4 |
查看答案和解析>>
科目: 来源: 题型:解答题
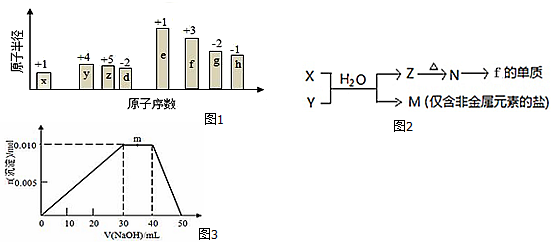
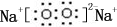 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com