
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
查看答案和解析>>
科目: 来源: 题型:解答题
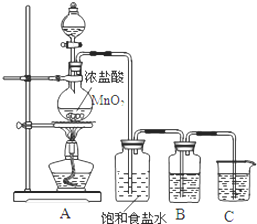 为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
为验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
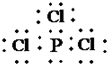 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| ⅠA | Ⅷ | ||||||
| ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| ② | ③ | ④ | ⑧ | ||||
| ⑤ | ⑥ | ⑦ | ⑨ | ||||
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaH的电子式为Na+[:H]- | |
| B. | NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同 | |
| C. | 微粒半径H-<Li+ | |
| D. | NaH与H2O反应时,水作氧化剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 最高价氧化物的水化物的酸性:Y<W | |
| C. | 原子序数:X>W>Z>Y | |
| D. | Z、Y的单质均可与H2反应,且反应的剧烈程度:Y>Z |
查看答案和解析>>
科目: 来源: 题型:解答题
| H2(g) | Cl2 (g) | HCl (g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 243 | a |
查看答案和解析>>
科目: 来源: 题型:解答题
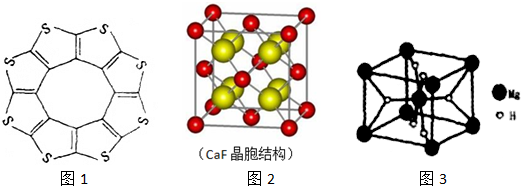
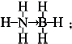 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com