
科目: 来源: 题型:解答题
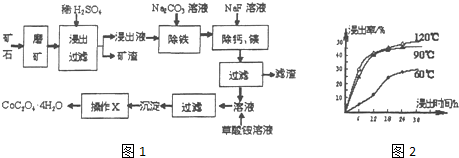
查看答案和解析>>
科目: 来源: 题型:选择题
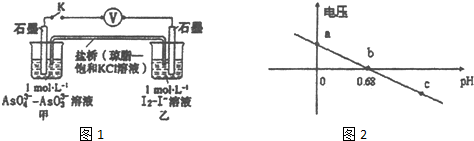
| A. | pH=5 时,负极电极反应式为2I--2e-═I2 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | a点时,盐桥中K+向左移动 | |
| D. | pH>0.68时,氧化性I2>AsO43- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④都要用到锥形瓶 | B. | ②③都要用到温度计 | ||
| C. | ③④都要用到酒精灯 | D. | ①②都要用到指示剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用乙醚从黄花蒿中提取青蒿素 | |
| B. | 用浸有酸性高锰酸钾的硅藻土作水果保鲜剂 | |
| C. | 生石灰用作煤炭燃烧的固硫剂 | |
| D. | 服用阿司匹林出现水杨酸反应时用小苏打解毒 |
查看答案和解析>>
科目: 来源: 题型:解答题
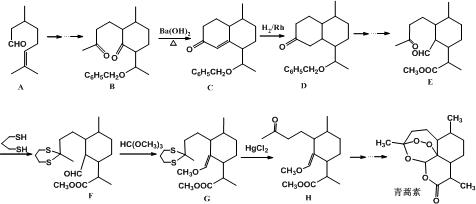
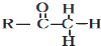 +
+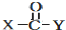 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$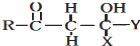
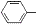 CH2CH2CHO)的路线流程图.路线流程图示例如下:
CH2CH2CHO)的路线流程图.路线流程图示例如下: .
.查看答案和解析>>
科目: 来源: 题型:解答题
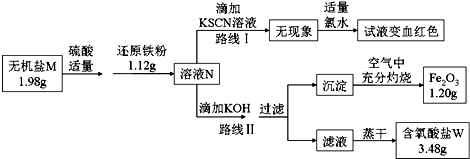
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| 溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
| pH | 7.5 | 11.6 | 9.7 | 8.3 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L | |
| C. | 等体积等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后 | |
| D. | 向Na2CO3溶液中通入少量的HF气体,化学反应方程式为:Na2CO3+2HF═CO2+H2O+2NaF |
查看答案和解析>>
科目: 来源: 题型:选择题
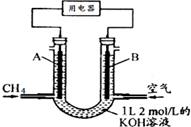 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )| A. | OH-由A端移向B端 | |
| B. | 0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+KOH═KHCO3+2H2O | |
| C. | 22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32-+3H2O=10HCO3- | |
| D. | V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com