
科目: 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应Cl2被氧化 | ||
| C. | 该反应不属于复分解反应 | D. | 生成1mol N2有6mol电子转移 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 2:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=8.3 的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大 |
查看答案和解析>>
科目: 来源: 题型:解答题
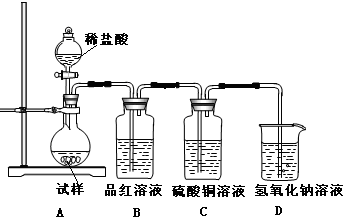
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 | |
| B. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| C. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度从而增大与氢氧化溶液的接触面积,从而加快油脂皂化反应速率 | |
| D. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| B. | 标准状况下,11.2 LSO3含有的分子数目为0.5 NA | |
| C. | 7.8gNa2O2所含的离子数为0.4NA | |
| D. | 11.2LCl2完全溶于NaOH溶液,电子转移数为0.5 NA |
查看答案和解析>>
科目: 来源: 题型:解答题
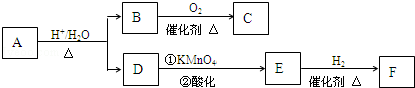
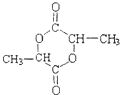 .
.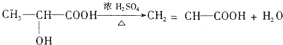 .
.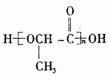 .
.查看答案和解析>>
科目: 来源: 题型:解答题
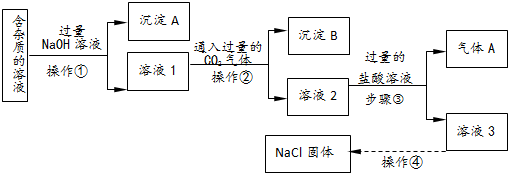
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com