
科目: 来源: 题型:解答题
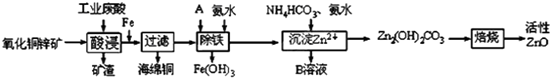
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(Cl-)=c(NH3•H2O)+c(NH4+) | |
| B. | c(Cl-)>c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | c(Cl-)+c(OH-)=c(Na+)+c(NH4+)+c(H+) | |
| D. | c(NH3•H2O)+c(OH-)=c(Na+)+c(NH4+)+c(H+) |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 在Na2CO3溶液中一定有:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| B. | 在NaHCO3溶液中一定有:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 在NH4Cl溶液中一定有:c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 在CH3COONa溶液中一定有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用10mL量筒量取8.10mL稀盐酸 | |
| B. | 用pH计测得某溶液的pH为2.3 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用50.00mL碱式滴定管量取20.00mL KMnO4溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=1的溶液中:Al3+、Mg2+、Cl-、SO42- | |
| B. | 使pH试纸显蓝色的溶液中:Cu2+、Fe2+、NO3-、SO42- | |
| C. | 滴入甲基橙指示剂呈红色的溶液中:K+、NH4+、CO32-、NO3- | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的溶液中:K+、NH4+、HCO3-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 L NH3溶于水后溶液中含有NA个NH4+ | |
| B. | 1L 0.1 mol•L-1的Na2CO3溶液中含有0.2 NA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液中含有0.1NAFe3+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下醋酸易挥发 | |
| B. | 醋酸能与水以任意比互溶 | |
| C. | 常温下0.1mol/L的醋酸钠溶液的pH约为9 | |
| D. | 10mL0.1mol/L的醋酸恰好能与10mL0.1mol/L的NaOH溶液完全反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
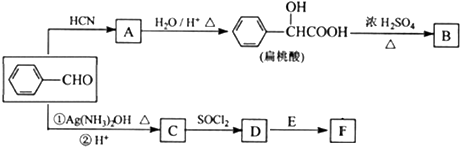

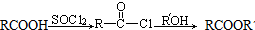 (R、Rˊ代表烃基)
(R、Rˊ代表烃基)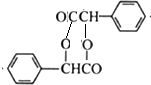 ,化合物C中的含氧官能团的名称是羧基.
,化合物C中的含氧官能团的名称是羧基. .
.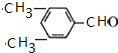 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com