
科目: 来源: 题型:选择题
| A. | NaH在水中显碱性 | |
| B. | NaH中氢离子电子层排布与氦原子相同 | |
| C. | NaH中氢离子半径比锂离子半径大 | |
| D. | NaH中氢离子被还原为H2 |
查看答案和解析>>
科目: 来源: 题型:解答题
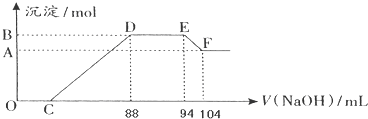
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 消耗氧气的体积为1.68 L | |
| B. | 混合气体中含NO21.12 L | |
| C. | 此反应过程中转移的电子为0.3 mol | |
| D. | 参加反应的硝酸是0.4mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| B. | 常温下pH=12的溶液:Na+、K+、SiO32-、NO3- | |
| C. | c(Fe3+)=0.1mol•L-1的溶液:H+、Al3+、I-、SCN- | |
| D. | 加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 22.4L氯气用氢氧化钠溶液充分吸收,反应中转移了0.5NA个电子 | |
| B. | 标准状况下分子总数为0.5 NA的H2O与CO2的总体积为11.2 L | |
| C. | 0.1 mol•L-1的NaCl溶液中含有0.1NA个Na+ | |
| D. | 2.3g钠与足量的水反应产生氢气的分子数为0.05NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 往某溶液中滴加BaCl2溶液,产生白色沉淀,则原溶液中一定含SO42- | |
| B. | 往某溶液中滴加稀硝酸酸化的硝酸银溶液,产生白色沉淀,则原溶液中一定含Cl- | |
| C. | 取某溶液进行焰色反应,透过蓝色钴玻璃焰色为紫色,则原溶液的溶质一定是钾盐 | |
| D. | 往某溶液中通入CO2,产生白色沉淀,则原溶液中一定含SiO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯水、液氯都含有氯气分子,均为混合物 | |
| B. | SiO2与Al2O3都既可以与酸又可以与碱反应,故都是两性氧化物 | |
| C. | 胶体与溶液的分散质粒子均可以通过滤纸 | |
| D. | 氢氟酸可用于刻蚀玻璃,是利用SiO2酸性氧化物的性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com