
科目: 来源: 题型:选择题
| A. | 将Fe(N03)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,则Fe(N03)2晶体已氧化变质 | |
| B. | 常温下,pH都为11的氢氧化钠溶液和氨水均加水稀释100倍,pH都变为9 | |
| C. | 25℃时,Ksp( BaC03)>Ksp( BaCrO4),则沉淀水体中的Ba2+选择Na2CrO4比Na2CO3好 | |
| D. | 将CH3CH2Br与NaOH溶液共热,冷却后取出上层溶液,加入AgNO3溶液,产生沉淀,则CH3CH2Br在NaOH溶液中发生了水解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 聚乙烯塑料的老化是因为发生了加成反应 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| D. | 在清洗地板时,84消毒液和洁厕灵(主要成分是盐酸)不能混合使用 |
查看答案和解析>>
科目: 来源: 题型:解答题
| F | Cl | Br | I | |
| 第一电离能((kJ•mol-1)) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
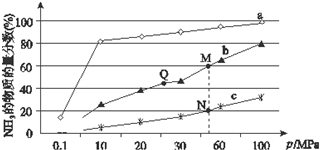 合成氨反应是化学上最重要的反应之一:
合成氨反应是化学上最重要的反应之一:查看答案和解析>>
科目: 来源: 题型:选择题
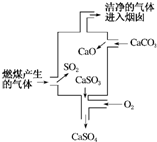
| A. | 使用此装置处理过的废气就不会对大气造成污染了 | |
| B. | 装置内发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用澄清的石灰水检验经过处理的废气是否达标 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X、Y、Z、W 元素的离子半径依次减小 | |
| B. | W 的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| C. | 若W 与Y的原子序数相差5,则二者形成的化合物的化学式可能为Y2W3或Y3W2 | |
| D. | W 与X形成的化合物只含离子键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液紫色褪色 | SO2具有漂白性 |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应 | 相同时间内HA与Zn反应生成的氢气更多 | HA是强酸 |
| C | 灼烧某白色粉末 | 火焰呈黄色 | 白色粉末中含有Na+,无K+ |
| D | 将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液中 | 有白色沉淀生成 | 证明非金属性S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-→CH3COO-+NH4++3NH3+2Aɡ↓+H2O | |
| C. | 向沸水中滴加FeCl3溶液制备胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| D. | 将Cl2溶于水中:Cl2+H2O═Cl-+2H++ClO- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁和酸反应,放出标准状况下的22.4L气体,转移的电子数必为2NA | |
| B. | 将标准状况下,11.2LN2和33.6LH2混合,在一定条件下充分反应,产生的NH3的分子数为2NA | |
| C. | 常温常压下,6g乙酸所含共价键数目为0.7NA | |
| D. | 1L 0.1mol•L-1碳酸钠溶液中,阴离子数目大于0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com