
科目: 来源: 题型:解答题
| W | X | Y | Z | |
| 结构 或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,将铁片置于足量浓硝酸中:Fe+4H++2NO3-═Fe2++2NO2↑+2H2O | |
| B. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 在溶液中FeI2与氯气3:4反应:2Fe2++6I-+4Cl2═2Fe3++3I2+8Cl- | |
| D. | 向Ba(OH)2溶液中加过量的NH4HSO4溶液:Ba2++2OH-+SO42-+H++NH4+═BaSO4↓+H2O+NH3•H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应速率是衡量化学反应进行快慢程度的物理量 | |
| B. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 | |
| C. | 在同一个反应中,用各物质表示的反应速率之比等于其化学方程式中的化学计量数之比 | |
| D. | 化学反应速率的常用单位有mol•L-1•s-1和mol/(L•min) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验操作 | 实验现象 | 结论 |
| 在一杯浑浊的水中加 少量Al2(SO4)3静置 | 烧杯中的水变澄清 | Al2(SO4)3可 以净水 |
| 在一杯浑浊的水中加 少量KCl,静置 | 烧杯中的水 仍然浑浊 | K+不能起净水作用 |
查看答案和解析>>
科目: 来源: 题型:选择题
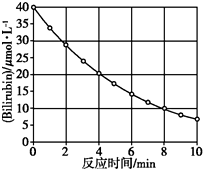 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )| A. | 2.5 μmol/( L•min)和2.0 μmol/L | B. | 2.5 μmol/( L•min)和2.5 μmol/L | ||
| C. | 3.0 μmol/( L•min)和3.0 μmol/L | D. | 5.0 μmol/( L•min)和3.0 μmol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在含有大量AlO2-的溶液中:Fe3+、Na+、NO3-、Cl- | |
| B. | 使淀粉碘化钾试纸变蓝的溶液中:K+、S2-、Cl-、HCO3- | |
| C. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| D. | 与金属铝反应只能放出氢气的溶液中:NH4+、Cl-、Na+、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.3 mol•L-1的Na2SO4溶液中含有的Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和S${O}_{4}^{2-}$的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol•L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.005 mol/(L•s) | ||
| C. | v(C)=0.8 mol/(L•min) | D. | v(D)=1.0 mol/(L•min) |
查看答案和解析>>
科目: 来源: 题型:解答题
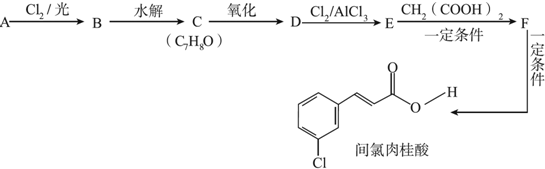
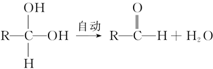
 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$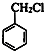 +HCl.
+HCl.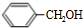 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$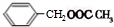 +H2O.
+H2O.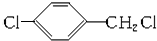 .
.查看答案和解析>>
科目: 来源: 题型:解答题
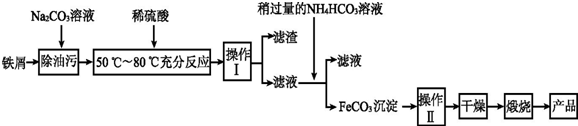
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com