
科目: 来源: 题型:选择题
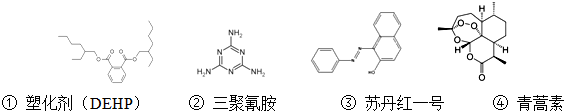
| A. | 塑化剂(DEHP)分子苯环上的二氯代物有六种不同的结构 | |
| B. | 三聚氰胺的分子式为C3N6H6 | |
| C. | 苏丹红一号分子中所有原子可能在同一平面上 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目: 来源: 题型:选择题
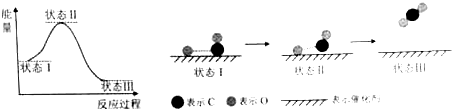
| A. | CO和O生成CO2是吸热反应 | B. | 在该过程中,CO断键形成C和O | ||
| C. | CO和O生成了具有极性共价键的CO2 | D. | 催化剂可改变该反应的焓变 |
查看答案和解析>>
科目: 来源: 题型:选择题
 天津“8•12”爆炸事故发生后,核心区出现了一个深达六七米已被氰化物等污染的巨大水坑.专业人员将污水抽出后,用专用槽车拉到“破氰装置”里进行处理.“破氰装置”里盛有的化学试剂主要是( )
天津“8•12”爆炸事故发生后,核心区出现了一个深达六七米已被氰化物等污染的巨大水坑.专业人员将污水抽出后,用专用槽车拉到“破氰装置”里进行处理.“破氰装置”里盛有的化学试剂主要是( )| A. | 氧化剂 | B. | 还原剂 | C. | 强酸 | D. | 强碱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | X | Y |
| A | SO2 | H2S |
| B | CO2 | Cl2 |
| C | NH3 | CO2 |
| D | SO2 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
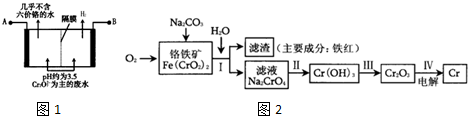
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.6 g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| B. | 1 mol NH3含有的电子数10NA | |
| C. | 常温常压下,22.4 L的氧气含氧原子数为2NA | |
| D. | 常温下,1 L0.1 mol•L-1AlCl3溶液中含Al3+数为0.1 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高纯度的硅单质广泛用于制作光导纤维 | |
| B. | 油脂在碱性条件下水解可制得肥皂 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀 | |
| D. | 使用太阳能等代替化石燃料,符合低碳节能减排的要求 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com