
科目: 来源: 题型:选择题
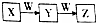 X、Y、Z、W均为中学化学常见物质,且X、Y、Z含有同一种元素,在一定条件下发生如图所示的转化关系,则W不可能是( )
X、Y、Z、W均为中学化学常见物质,且X、Y、Z含有同一种元素,在一定条件下发生如图所示的转化关系,则W不可能是( )| A. | Al | B. | Si | C. | O2 | D. | Fe |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用分液漏斗分液时,先打开旋塞,待下层液体完全分出后,关闭旋塞,再从上口倒出上层液体 | |
| B. | 在油脂皂化反应实验中,用玻璃棒蘸取反应液滴入热水中,若无油滴浮于液面上,说明皂化反应已经完全 | |
| C. | 在中和热测定实验中,盐酸和NaOH溶液的总质量m g,反应前后体系温度变化△t℃,反应液的比热容为c J•g-1•℃-1,则生成1mol水放出的热量为cm△t×10-3kJ | |
| D. | 同一温度下,可通过观察出现浑浊的快慢来探究浓度对Na2S2O3与稀硫酸反应速率的影响 |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O
+H2O
查看答案和解析>>
科目: 来源: 题型:多选题
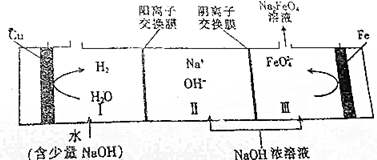
| A. | 电解时,铁棒连接电源的负极 | |
| B. | 铁棒的电极反应式为Fe+6e-+8OH-═FeO42-+4H2O | |
| C. | 若Ⅲ区生成1mol Na2FeO4,Ⅰ区将生成67.2L H2 | |
| D. | 电解总反应的离子方程式为Fe+2OH-+2H2O$\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 分子中所有原子都有可能处于同一平面上 | |
| B. | 都能在空气中燃烧,且燃烧时均伴有黑烟 | |
| C. | 都能被KMnO4酸性溶液氧化而使其褪色 | |
| D. | 都能与足量的溴水发生加成反应生成相同的四溴代烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )| A. | 反应CO(g)+2H2O(g)?CH3OH(g)的△H<0 | |
| B. | 图示a点n(CO):n(H2)=0.5,CO转化率最高 | |
| C. | 若在状态Ⅰ和Ⅱ时,再向体系中充入He,重新达到平衡,c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ) | |
| D. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
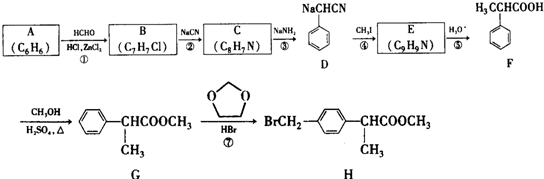
 +HCHO+HCl$\stackrel{ZnCl_{2}}{→}$
+HCHO+HCl$\stackrel{ZnCl_{2}}{→}$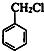 +H2O.
+H2O.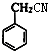 ;E的结构简式为
;E的结构简式为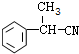 .
. .
.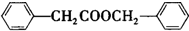 的合成路线
的合成路线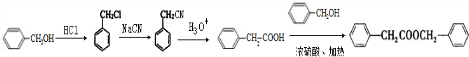 .
.查看答案和解析>>
科目: 来源: 题型:解答题
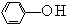 )中羟基被硫羟基取代生成苯硫酚(
)中羟基被硫羟基取代生成苯硫酚(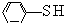 ),苯硫酚的酸性比苯酚的酸性强,原因是S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子.
),苯硫酚的酸性比苯酚的酸性强,原因是S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子.| 物质 | 熔点/℃ | 沸点/℃ | 水溶液 |
| 甲醇 | -97 | 64.7 | 互溶 |
| 甲硫醇 | -123 | 6.8 | 不溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com