
科目: 来源: 题型:解答题

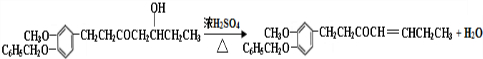 .
. 或
或 ,1mol该物质在一定条件下与足量的NaOH溶液反应,需要的NaOH的物质的量是3或2mol.
,1mol该物质在一定条件下与足量的NaOH溶液反应,需要的NaOH的物质的量是3或2mol.查看答案和解析>>
科目: 来源: 题型:解答题
 锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:
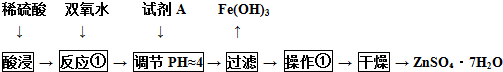
锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:| 序号 | 烧瓶中的物质 | 气体体积 | MnO2的作用 |
| 实验1 | 足量MnO2 | 56mL | |
| 实验2 | 足量MnO2和稀硫酸 | 112mL |
查看答案和解析>>
科目: 来源: 题型:解答题
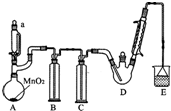 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目: 来源: 题型:选择题
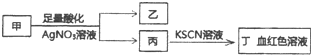
| A. | 若乙为白色沉淀,则甲可能含有SiO32- | |
| B. | 若乙为黄色沉淀,则甲可能为FeI3 | |
| C. | 若乙为浅黄色沉淀,则甲可能含有S2- | |
| D. | 若乙为浅黄色沉淀,则甲可能是FeBr2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
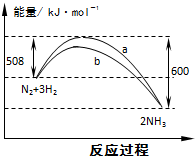
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1molN2和3molH2充分反应后,放出92kJ热量 | |
| C. | b曲线可能是加入催化剂时的能量变化曲线 | |
| D. | 加入正催化剂可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目: 来源: 题型:解答题

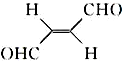 ,下列叙述正确的有AD.
,下列叙述正确的有AD.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
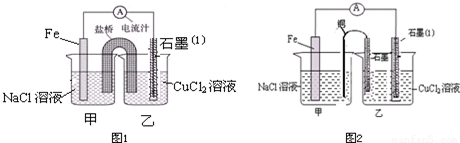
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素的第一电离能越大,其金属性越强 | |
| B. | 元素的第一电离能越小,其金属性越强 | |
| C. | 金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关 | |
| D. | 同周期元素,第一电离能随原子序数增大逐渐增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com