
科目: 来源: 题型:解答题
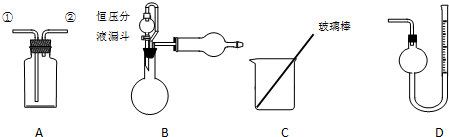
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH5的电子式为: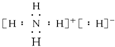 | |
| B. | 分馏、干馏、裂化都是化学变化 | |
| C. | 2-甲基-1-丁烯的结构简式: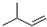 | |
| D. | NaHSO4和Na2O2的阴、阳离子个数比均为1:2 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
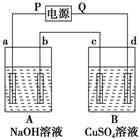 按图中装置实验,A、B两烧杯分别盛放200g 10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得电路通过电子0.5mol,试回答:
按图中装置实验,A、B两烧杯分别盛放200g 10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得电路通过电子0.5mol,试回答:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 合成氨的化学反应限度最大 | |
| B. | N2的转化率最高 | |
| C. | 催化剂的活性最大 | |
| D. | NH3在平衡混合气体中的体积分数最大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2NO(g)+O2(g)═2NO2(g) | B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g) | ||
| C. | NH4NO3(s)═NH4+(aq)+NO3-(aq) | D. | H2(g)+Cl2(g)═2HCl(l) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石墨周围有大量的Na+ | |
| B. | 铁棒质量增加 | |
| C. | 电子通过电解质溶液由石墨棒流向铁棒 | |
| D. | 铁棒电极发生氧化反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com