
科目: 来源: 题型:选择题
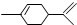 ),下列有关它的推测不正确的是( )
),下列有关它的推测不正确的是( )| A. | 分子式为C10H16 | |
| B. | 常温下呈液态难溶于水 | |
| C. | 所有原子可能共平面 | |
| D. | 与过量溴的CCl4 溶液反应后产物(如图)为: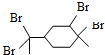 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子式为C3H6Cl2的同分异构体有四种 | |
| B. | 分子式为C8H10的芳香烃有3个,分别为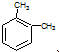 、 、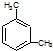 和 和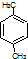 | |
| C. | 分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3 | |
| D. | 二氯甲烷有两种同分异构体 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,违背了泡利不相容原理.
,违背了泡利不相容原理.查看答案和解析>>
科目: 来源: 题型:解答题
 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HBrO3 | B. | XeF2 | C. | HBrO4 | D. | Xe |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化硅和氯化镁熔化 | B. | 碘和氯化铵受热变成气体 | ||
| C. | 水和干冰的气化 | D. | 氯化钠和氯化氢溶于水 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
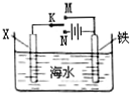
| A. | 若X为锌棒,开关K置于M处,可减缓铁的腐蚀 | |
| B. | 若X为锌棒,开关K置于M处,铁电极的反应:Fe-2e→Fe2+ | |
| C. | 若X为碳棒,开关K置于N处,可减缓铁的腐蚀 | |
| D. | 若X为碳棒,开关K置于N处,铁电极的反应:2H++2e→H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com