
科目: 来源: 题型:多选题
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| C. | 锌摄入量过多,也会引起缺铁性贫血 | |
| D. | 为了防止龋齿,人人都适合使用含氟牙膏 |
查看答案和解析>>
科目: 来源: 题型:解答题
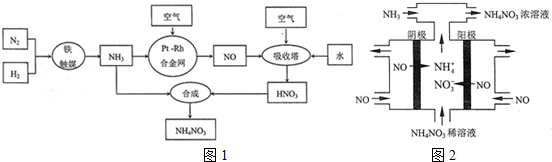
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
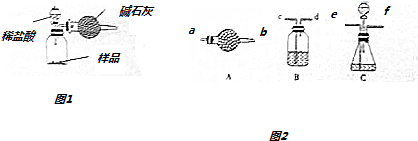
| 选用的仪器 | |||||
| 添加的药品(或必要的操作) |
查看答案和解析>>
科目: 来源: 题型:解答题
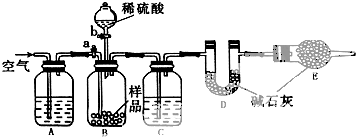
查看答案和解析>>
科目: 来源: 题型:解答题
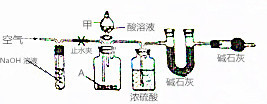 碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:查看答案和解析>>
科目: 来源: 题型:解答题
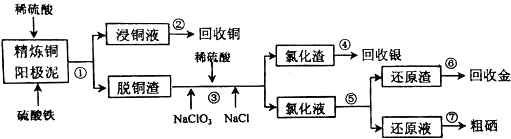
查看答案和解析>>
科目: 来源: 题型:解答题
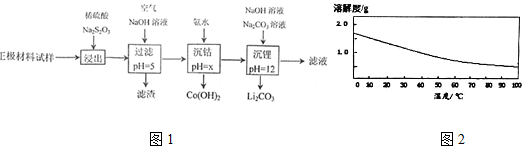
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)3 |
| 开始沉淀的pH | 3.1 | 7.1 | 2.2 |
| 完全沉淀的pH | 4.7 | 9.7 | 3.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
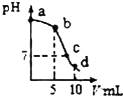 25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.
25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
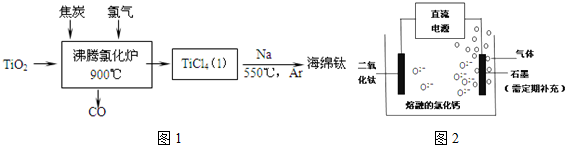
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com