
科目: 来源: 题型:选择题
| A. | 元素非金属性由强到弱的顺序是:Z>Y>X | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H4YO4 | |
| C. | 3种元素的气态氢化物中,Z的气态氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为 Z>Y>X |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实现现象 | 结论 |
| A | 向浓度均为0.1mol/L NaCl、KI混合液中逐滴加入AgNO3溶液 | 先出现黄色沉淀 | 溶解性:AgCl>AgI |
| B | 溴乙烷与NaOH的乙醇溶液共热,将逸出气体通入酸性高锰酸钾溶液中 | 溶液紫色褪去 | 证明有乙烯生成 |
| C | 向X的溶液中滴入浓NaOH溶液,将干燥红色石蕊试纸置于管口 | 无明显现象 | X溶液中无NH4+ |
| D | 将SO2气体通入Ba(NO3)2溶液 | 产生白色沉淀 | 沉淀为BaSO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 550℃时,若充入惰性气体,v正、v逆 均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为75.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向正反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=23.04 p总 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液的pH值可能是5 | B. | 此溶液不存在 | ||
| C. | 该溶液的pH值一定是9 | D. | 该溶液的pH值可能是7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 燃放烟花爆竹 | B. | 为城市主干道洒水保洁 | ||
| C. | 大面积开发土建项目 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同温下分别在100g水中最多能溶解的无水CuSO4和CuSO5•5H2O的质量 | |
| B. | 纯水在25℃和90℃时的pH值 | |
| C. | 25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数 | |
| D. | 在反应NH3+NO→N2+H2O中,被氧化和被还原的N原子数 |
查看答案和解析>>
科目: 来源: 题型:解答题
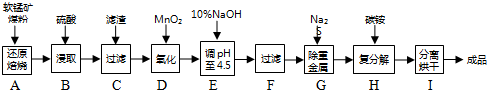
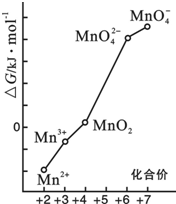
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com