
科目: 来源: 题型:选择题
| A. | CO2(HCl):用饱和NaHCO3溶液 | B. | CO2(SO2):用饱和KMnO4溶液 | ||
| C. | Cl2(HCl):用饱和NaCl溶液 | D. | SO2(HCl):用饱和NaOH溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 任何元素的原子都是由核外电子和核内中子、质子组成 | |
| D. | ${\;}_{17}^{35}Cl$与${\;}_{17}^{37}Cl$得电子能力相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ③④ | B. | ③④⑥ | C. | ④⑤ | D. | ④⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过氧化钠与水反应时,生成2.24L氧气转移的电子数为0.2NA | |
| B. | 1L 0.1mol•L-1的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| C. | 标准状况下,2.24L三氯甲烷分子中含有共价键总数为0.4NA | |
| D. | 15g${\;}_{\;}^{14}{C}_{\;}^{16}O$和15g${\;}_{\;}^{12}{C}_{\;}^{18}O$中含有的中子数均为8NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 向NaNO2溶液中滴加酸性KMnO4溶液:5NO2-+2MnO4-+3H2O═5NO3-+2Mn2++6OH- | |
| C. | 醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | M的单质能够用来制造光导纤维 | |
| B. | Z、W、M的氧化物均可做耐高温材料 | |
| C. | 工业上常用电解熔融氯化物的方法制备Z、W的单质 | |
| D. | Y的单质都有剧毒,而且其着火点低,常保存在冷水中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放出218 kJ | B. | 放出109kJ | C. | 吸收218 kJ | D. | 吸收109 kJ1 |
查看答案和解析>>
科目: 来源: 题型:解答题
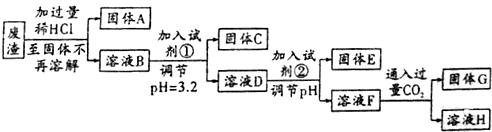
| 离子 | 以氢氧化物形式完全沉淀时所需pH | 氢氧化物沉淀完全溶解时所需pH |
| Fe3+ | 3.2 | |
| A13+ | 5.3 | 11.9 |
| Mg2+ | 12.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com