
科目: 来源: 题型:解答题
 某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.查看答案和解析>>
科目: 来源: 题型:选择题
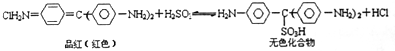
| A. | 品红溶液中同时通入Cl2、SO2,漂白效果会更好 | |
| B. | 加热可判断品红褪色是通入SO2还是通入Cl2引起的 | |
| C. | “无色化合物”分子中,19个碳原子都可能在同一平面上 | |
| D. | 无色化合物中的官能团有苯环、磺酸基、氨基 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该元素基态原子核外共有7种运动状态不同的电子 | |
| B. | 该元素位于周期表的S 区,属于金属元素 | |
| C. | 该元素在周期表中的位置第四周期第VA族 | |
| D. | 该元素M层含有11个电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p2 Y:2s22p4 | ||
| C. | X:3s23p1 Y:3s23p4 | D. | X:3s2 Y:2s22p3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 金属的用途 | 对应的金属物理性质 |
| 金可制成比纸还薄的金箔 | ③ |
| 用铁、铝等做炊具 | ② |
| 用铜制作印刷电路 | ① |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com