
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
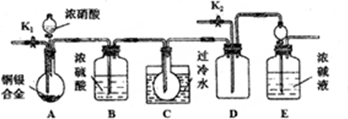
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | M(X)>M(Y) | B. | M(X)<M(Y) | C. | M(X)=M(Y) | D. | 无法确定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L溶液中含0.3NA个钾离子 | B. | 1L溶液中含0.9NA个离子(K+、SO42-) | ||
| C. | 2L溶液中钾离子浓度是1.2mol/L | D. | 2L溶液中含0.6 NA个离子(K+、SO42-) |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(N2)正=v(NH3)逆 | |
| B. | 单位时间内3molH-H键断裂,同时6molN-H键断裂 | |
| C. | n(N2):n(H2):(NH3)=1:3:2 | |
| D. | 混合气体的密度不再改变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 离子组 | 分析 |
| A | Na+、Cu2+、SO42-、Cl- | 能大量共存于同一溶液中,通入过量NH3最终产生蓝色沉淀 |
| B | NH4+、Al3+、S2-、Cl- | 不能大量共存于同一溶液中,因为有Al2S3沉淀产生 |
| C | H+、Fe2+、SO42-、Cl- | 能大量共存于同一溶液中,加入KNO3固体后溶液颜色发生变化 |
| D | Na+、K+、HCO3-、OH- | 不能大量共存于同一溶液中,因为HCO3-与OH-反应有CO2生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 砷的第一电离能高于磷而电负性低于磷 | |
| B. | 三氯化砷与三氯化氮分子都是三角锥构型 | |
| C. | 最高氧化物对应水化物的化学式为HAsO3 | |
| D. | 砷的第一电离能小于同周期硒的电离能 |
查看答案和解析>>
科目: 来源: 题型:填空题
 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com