
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O | |
| B. | 向AgCl悬浊液中滴加NaI溶液,白色沉淀变成黄色AgCl+I-═AgI+Cl- | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
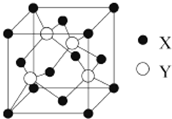 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.查看答案和解析>>
科目: 来源: 题型:解答题
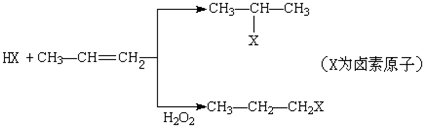
 的物质,该物质是一种香料.
的物质,该物质是一种香料.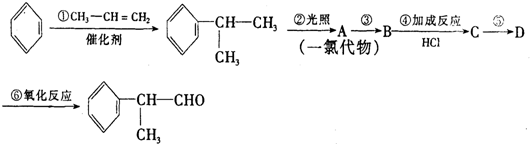
 ,
,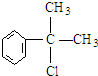 .
.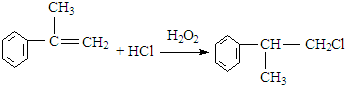 .反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):
.反应⑤的化学方程式为(有机物写结构简式,并注明反应条件): +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$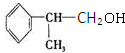 +NaCl.
+NaCl.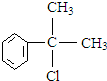 的水解产物
的水解产物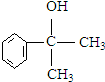 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. ,
, ,
, .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  除去S02中的少量HC1,可将混合气体通人饱和Na2S03溶液 除去S02中的少量HC1,可将混合气体通人饱和Na2S03溶液 | |
| B. |  粘在试管内壁的硫单质,可用热的稀盐酸洗涤 粘在试管内壁的硫单质,可用热的稀盐酸洗涤 | |
| C. |  稀盐酸、NaOH、AICl3、Ba(OH)2四瓶无色溶液,可用NaHC03溶液鉴别 稀盐酸、NaOH、AICl3、Ba(OH)2四瓶无色溶液,可用NaHC03溶液鉴别 | |
| D. |  将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的 将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 2 Ag(s)+Cd2+( aq)═2 Ag+(aq)+Cd(s) | B. | Co2+( aq)+Cd(s)═Co(s)+Cd2+( aq) | ||
| C. | 2 Ag+(aq)+Cd(s)═2Ag(s)+Cd2+( aq) | D. | 2Ag+( aq)+Co( s)═2 Ag(s)+Co2+( aq) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
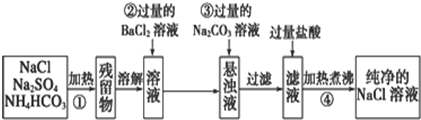
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com