
科目: 来源: 题型:选择题
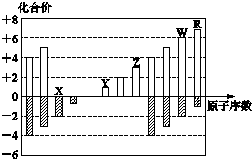
| A. | 离子半径:Z>Y>X | |
| B. | 最高正价氧化物对应的水化物的酸性:R<W | |
| C. | 氢化物的还原性:R>W | |
| D. | R的单质能与W的氢化物反应,可证明非金属性:R>W |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属在原电池中做正极被保护 | |
| B. | 原电池中阴离子向负极移动 | |
| C. | 常温下,强酸强碱在稀溶液中反应的中和热是-57.3KJ.mol-1 | |
| D. | 用惰性电极电解CuSO4溶液,外电路中每通过1mol电子,溶液中就产生1mol H+ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | K+、Ba2+、Al3+、Fe3+ |
| 阴离子 | OH-、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目: 来源: 题型:解答题
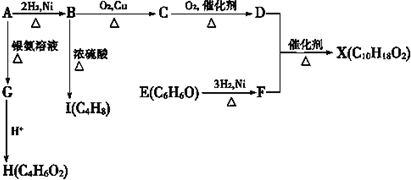
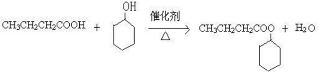 .
.查看答案和解析>>
科目: 来源: 题型:解答题
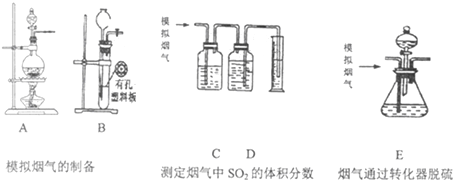
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 )是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:
)是一种可降解的聚酯类高分子材料,在材料的生物相容性方面有很好的应用前景.PPG的一种合成路线如下:


 .
. .
. .
. .
. 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{加热}^{NaOH/醇}$CH2=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH.查看答案和解析>>
科目: 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/ml | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)始/ml | 0.00 | 0.20 | 0.10 | 0.10 |
| V(NaOH)终/ml | 14.98 | 15.20 | 15.12 | 16.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com