
科目: 来源: 题型:解答题
 ④
④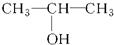 ⑤
⑤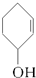 ⑥
⑥
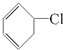 ⑧
⑧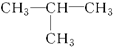 ⑨CH3-CH═CH2⑩
⑨CH3-CH═CH2⑩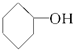 ⑪
⑪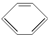 ⑫CH3Cl
⑫CH3Cl查看答案和解析>>
科目: 来源: 题型:解答题
 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
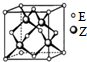 X、Y、Z、R、W、E为前四周期元素且原子序数依次增大.X的单质与Y的单质在放电条件下反应产生大气污染物,R基态原子的M能层上有3对成对电子,W核外有5个未成对电子.Y、Z分别形成氢化物Q和J,已知Q与J摩尔质量相等,Q的水溶液中加入少量WY2,立即产生大量气泡.E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
X、Y、Z、R、W、E为前四周期元素且原子序数依次增大.X的单质与Y的单质在放电条件下反应产生大气污染物,R基态原子的M能层上有3对成对电子,W核外有5个未成对电子.Y、Z分别形成氢化物Q和J,已知Q与J摩尔质量相等,Q的水溶液中加入少量WY2,立即产生大量气泡.E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Y元素最高价氧化物对应的水化物化学式H2YO4 | |
| B. | 原子半径由大到小的顺序为:Z>Y>W | |
| C. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 | |
| D. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{A}{W+n}$(N-m)mol | B. | $\frac{W}{A+n}$(N+n)mol | C. | $\frac{W}{A+n}$(A-N+n)mol | D. | $\frac{W}{A+n}$(N-A-n)mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2P1>P2 | B. | 2P1=P2 | C. | 2P1<P2 | D. | P1>P2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 检验甲酸中是否混有乙醛,可向样品中加入足量NaOH溶液以中和甲酸后,再做银镜反应实验或与新制Cu(OH)2共热的实验 | |
| C. | 除去苯中的少量苯酚:加入适量NaOH溶液,振荡、静置、分液 | |
| D. | 液态溴乙烷中加入稀NaOH溶液共煮几分钟,然后加入稀硝酸酸化,再加入AgNO3溶液检验溴乙烷中是否含有溴元素 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化钠溶液中加入少量碳酸氢钙溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 氯气和水反应:Cl2+H2O═2H++Cl-+Cl-+ClO- | |
| C. | 二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com