
科目: 来源: 题型:选择题
| A. | 无色溶液中:Na+、Cl-、SO42-、Fe3+ | |
| B. | 在强酸性的溶液中:Na+、SO42-、Cl-、NH4+ | |
| C. | 使紫色石蕊试液变红的溶液中:Na+、Mg2+、CO32-、Cl- | |
| D. | 含SO42-的水溶液中:K+、Ba2+、Cl-、Br- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2SiO3 H2S CO2 | |
| B. | H2O NH3•H2O HClO HF | |
| C. | H2SO3 Ba(OH)2 BaSO4 | |
| D. | Cu(OH)2 CH3COOH C2H5OH CH3COONa |
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
查看答案和解析>>
科目: 来源: 题型:填空题
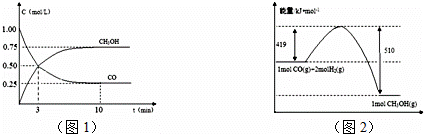
查看答案和解析>>
科目: 来源: 题型:解答题
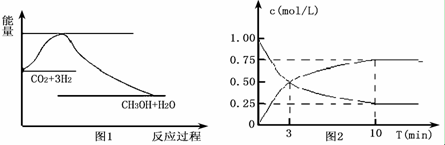
查看答案和解析>>
科目: 来源: 题型:选择题
 用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )| A. | 铜棒为正极,其电极反应式为2H++2e-═H2↑ | |
| B. | 烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应中消耗锌的质量为13g | |
| D. | 导线中通过的电子的物质的量为0.2mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | r(Al)>r(Si)>r(C)>r(N) | B. | r(Na+)<r(Mg2+)<r(Al3+)<r(F-) | ||
| C. | r(K+)>r(Ca2+)>r(S2-)>r(Cl-) | D. | r(N)<r(S)<r(O)<r(P) |
查看答案和解析>>
科目: 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | E | F | H | I | K | |||
| 3 | B | C | D | G | J |
查看答案和解析>>
科目: 来源: 题型:填空题
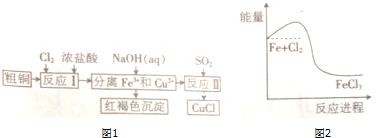
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=7的溶液中:Fe3+、NH4+、Cl-、N03- | |
| B. | 水电离出的c(H+)=$\sqrt{{k}_{w}}$的溶液中:Na+、S042-、C032-、K+ | |
| C. | 由水电离的c(OH-)=1×10-2mol•L-1的溶液中:Cl-、CH3COO-、K+、AlO2- | |
| D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、N03-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com