
科目: 来源: 题型:选择题
| A. | c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H+) | B. | c(H+)>c(OH-) | ||
| C. | 2 c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) | D. | c(OH-)+c(S2-)=c(H+)+c(HS-)+2 c(H2S) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.92g | B. | 0.69g | C. | 0.46g | D. | 0.23g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 明矾在水中形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 氧化铝常被用于制作作耐火材料 | |
| C. | Fe2O3俗称铁红,常用作红色的油漆和涂料 | |
| D. | Na2O2具有强氧化性,不能用作呼吸面具中的供氧剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2g | B. | 3g | C. | 3.5g | D. | 4.5g |
查看答案和解析>>
科目: 来源: 题型:选择题
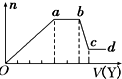 某无色稀溶液X中,可能含有如表所列离子中的某几种.
某无色稀溶液X中,可能含有如表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则X中一定含有CO32-、SiO32-、AlO2-和Na+ | |
| B. | 若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH4+、Cl- | |
| C. | 若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-═NH3↑+H2O | |
| D. | 若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+ 物质的量之比为1:1:2 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ②③⑤⑥⑦ | D. | ④⑥⑦⑧ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | △H3+2△H1+2△H2 | B. | △H3+2△H1+△H2 | C. | △H3+2△H1-△H2 | D. | △H3+2△H1-2△H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 具有氧化性的物质在反应中一定做氧化剂 | |
| B. | 氧化还原反应的实质是电子转移 | |
| C. | 某元素从游离态变为化合态,该元素一定被氧化 | |
| D. | 反应中当有一种元素被氧化时,一定有另一种元素被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com