
科目: 来源: 题型:选择题
| A. | NH4+、CH3COO-、Ca2+、Cl- | B. | Fe3+、Ag+、SO42-、NO3- | ||
| C. | Cu2+、H+、S2-、NO3- | D. | SCN-、Fe3+、K+、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3molH2+2molN2 | B. | 2molNH3+1molN2 | ||
| C. | 3molN2+1molH2 | D. | 0.1molNH3+0.95molN2+2.85molH2 |
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 漂白粉、次氯酸溶液和明矾都是混合物 | |
| B. | 不能通过化合反应制得FeCl2和Fe(OH)3 | |
| C. | 铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧 | |
| D. | 用强光照射装满次氯酸的试管(倒置于水槽中)可收集到两种气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Zn+2HCl═ZnCl2+H2↑ 1mol 1mol 3.25g x L | |
| B. | Zn+2HCl═ZnCl2+H2↑ 65g 1L 3.25g x L | |
| C. | Zn+2HCl═ZnCl2+H2↑ 1mol 22.4L 0.05mol x L | |
| D. | Zn+2HCl═ZnCl2+H2↑ 65g 1mol 3.25g x L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,则一定有SO42- | |
| C. | 用NaOH溶液能鉴别Mg( NO3)2、Cu( NO3)2和NaNO3三种溶液 | |
| D. | 加入硝酸银溶液后产生白色沉淀,再加盐酸,白色沉淀不消失,一定有Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| 物质 | 杂质 | 除杂试剂或操作方法 | |
| A. | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
| B. | FeSO4 | CuSO4 | 加入NaOH溶液,过滤 |
| C. | NaCl溶液 | I2 | 加酒精,萃取分液 |
| D. | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
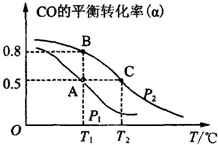 (1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.
(1)已知:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g),△H=-247kJ/mol.一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是AE.| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.01 | 0.2 | 0.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com