
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
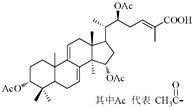 某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )
某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如图所示,下列关于该有机物的说法不正确的是( )| A. | 能与Br2发生加成反应 | B. | 能发生酯化反应 | ||
| C. | 能发生水解反应 | D. | 分子中有7个手性碳原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.5×10-3 g | B. | 7×10-4 g | C. | 4.52×10-3 g | D. | 4.52×10-2 g |
查看答案和解析>>
科目: 来源: 题型:解答题
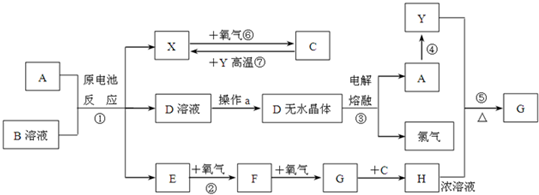
查看答案和解析>>
科目: 来源: 题型:解答题
 主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高.请回答下列问题:
主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
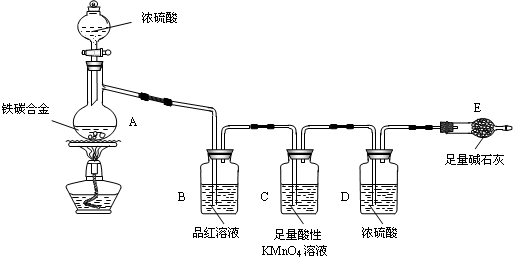
查看答案和解析>>
科目: 来源: 题型:解答题
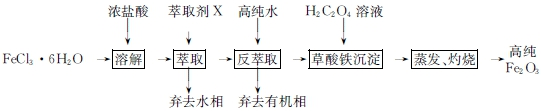
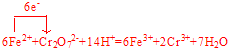 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com