
科目: 来源: 题型:解答题
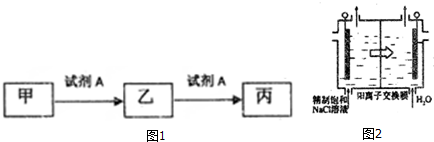
 .二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠(NaClO3)和另一种氯的含氯酸盐,同时生成水,该反应的离子方程式为2ClO2+2OH-═ClO3-+ClO2-+H2O
.二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠(NaClO3)和另一种氯的含氯酸盐,同时生成水,该反应的离子方程式为2ClO2+2OH-═ClO3-+ClO2-+H2O查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 | |
| D. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| D. | 滴定过程中不小心将液体从锥形瓶溅出 |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 9gD2O和9gH2O中含有的质子数均为5NA | |
| B. | 2L0.5mol/LH2SO3溶液中含有的H+数小于2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
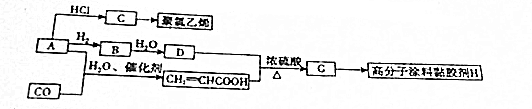
 ,A→C的反应类型:加成反应.
,A→C的反应类型:加成反应.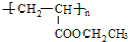 ,写出D的同分异构体的结构简式:CH3OCH3.
,写出D的同分异构体的结构简式:CH3OCH3.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4、3、5 | B. | 4、3、6 | C. | 2、5、4 | D. | 4、6、4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在熔融电解质中,O2-向正极定向移动 | |
| B. | 电池的总反应是:2C4H10+13O2═8CO2+10H2O | |
| C. | 通入空气的一极是正极,电极反应为:O2+4e-+2H2O═4OH- | |
| D. | 通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-═4CO2↑+5H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | Na2O,NaOH,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com