
科目: 来源: 题型:选择题
| A. | 因为液态氨气化时吸热,可用液态氨作制冷剂 | |
| B. | 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应 | |
| C. | 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用 | |
| D. | 铝能置换出氧化铁中的铁,钢铁工业利用铝热反应冶炼铁 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀释溶液,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数增大 | |
| D. | 通入CO2,溶液pH减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,0.4g D2气体分子含有的中子数小于0.2NA | |
| B. | 含有0.32g氧元素的二氧化硅中含有的硅氧键数目为0.02NA | |
| C. | 11.2L Cl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA | |
| D. | 7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2HBr+Na2CO3═2NaBr+H2O+CO2↑ | B. | 2HBr+CaCO3═CaBr2+H2O+CO2↑ | ||
| C. | HBr+NaOH═NaBr+H2O | D. | 2HBr+2Ag═AgBr+H2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
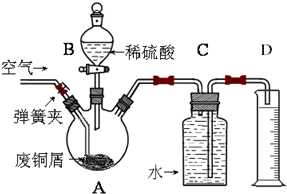
查看答案和解析>>
科目: 来源: 题型:解答题
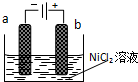
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com