
科目: 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |
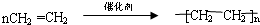 .
.查看答案和解析>>
科目: 来源: 题型:选择题
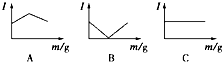 在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.| A | B | C | |
| A | ① | ② | ③ |
| B | ④ | ②③ | ① |
| C | ③ | ①② | ④ |
| D | ② | ①③ | ④ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇 | |
| B. | 将无水乙醇和浓硫酸按体积比3:1混合,加热至170℃制取乙烯 | |
| C. | 蔗糖水解用浓硫酸作催化剂 | |
| D. | 油脂皂化反应后,反应混合物中加入食盐可将肥皂分离出来 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验室用石灰石和盐酸反应制取CO2:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | H2O2溶液中滴加酸性KMnO4溶液:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | NaHCO3溶液与足量Ba(OH)2溶液反应:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
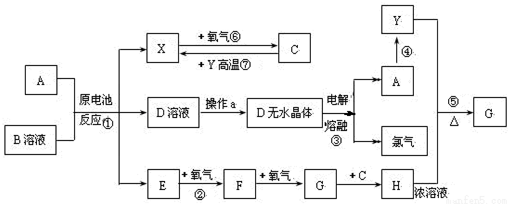

查看答案和解析>>
科目: 来源: 题型:解答题
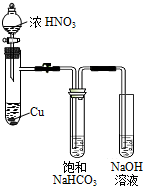 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
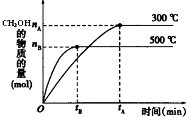 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com