
科目: 来源: 题型:选择题
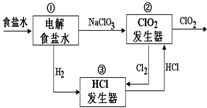 利用食盐水制取ClO2的工业流程如右图所示,
利用食盐水制取ClO2的工业流程如右图所示,| A. | 装置①中H2是阴极产物 | |
| B. | 装置②的阴极电极反应式为2ClO3-+12H++10e-=Cl2↑+6H2O | |
| C. | 该流程中Cl2、NaCl都可以循环利用 | |
| D. | 为了使H2完全转化为HCl,需要向装置③中补充Cl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
| A. | Z、Q均为ⅣA族元素 | |
| B. | X、Y、M三种元素中金属性最强的是M | |
| C. | R、Z形成的R2Z分子是非极性分子 | |
| D. | M的氢氧化物和Y的氢氧化物都能与氢氧化钠溶液反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 配制银氨溶液 | 向3mL2%的AgNO3溶液中滴入2滴2%的氨水 |
| B | 分离提纯鸡蛋清中的蛋白质 | 向鸡蛋清溶液中加入醋酸铅溶液,充分振荡后过滤,将不溶物加入蒸馏水中 |
| C | 检验蔗糖水解溶液的还原性 | 取2mL 20%的蔗糖溶液,加入少量稀硫酸,水浴后取少量溶液,加入几滴新制Cu(OH)2,加热 |
| D | 检验溴乙烷在NaOH溶液中是否发生水解 | 将溴乙烷与NaOH溶液共热.冷却后,取出上层溶液,用稀硝酸酸化,加入AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O=2HNO3+NO | |
| B. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O | |
| C. | Cu与稀硝酸反应制取硝酸铜:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3(胶体)+3H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 福尔马林可作食品的保鲜剂 | |
| B. | 聚乙烯塑料制品可作食品的包装材料 | |
| C. | 碳酸氢钠可于治疗胃酸过多症 | |
| D. | 食盐可作调味剂,也可作食品防腐剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
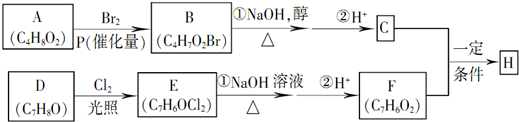
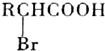
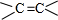 ;
;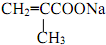 +NaBr+2H2O,该反应的类型为消去反应;
+NaBr+2H2O,该反应的类型为消去反应; $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O.
+H2O.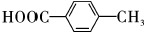 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途.
第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下生成N的体积为$\frac{22.4(n-m)}{51}$L | |
| B. | 沉淀中OH-的质量为17bVg | |
| C. | 恰好溶解后溶液中的NO3-的物质的量为$\frac{bV}{1000}$mol | |
| D. | 与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{bV}{1000}$)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com